化學反應,來自初中的知識
化學反應是指分子破裂成原子,原子重新排列組合生成新分子的過程,稱為化學反應。在反應中常伴有發光發熱變色生成沉淀物等,判斷一個反應是否為化學反應的依據是反應是否生成新的分子。
化學反應的本質是舊化學鍵斷裂和新化學鍵形成的過程。
在反應中常伴有發光、發熱、變色、生成沉淀物等。判斷一個反應是否為化學反應的依據是反應是否生成新的物質。根據化學鍵理論,又可根據一個變化過程中是否有舊鍵的斷裂和新鍵的生成來判斷其是否為化學反應。
按電子得失可分為:氧化還原反應、非氧化還原反應;氧化還原反應包括:自身氧化還原,還原劑與氧化劑反應,異構化:(A →B) :化合物是形成結構重組而不改變化學組成物。
按反應物與生成物的類型分四類:化合反應、分解反應、置換反應、復分解反應。
化學合成:化合反應
簡記為:A + B = C:二種以上元素或化合物合成一個復雜產物。即由兩種或兩種以上的物質生成一種新物質的反應。
化學分解:分解反應
簡記為:A = B + C :化合物分解為構成元素或小分子。即化合反應的逆反應。它是指一種化合物在特定條件下分解成兩種或兩種以上較簡單的單質或化合物的反應。
置換反應:單取代反應
簡記為:A+BC=B+AC :表示額外的反應元素取代化合物中的一個元素。即指一種單質和一種化合物生成另一種單質和另一種化合物的反應。
置換關系是指組成化合物的某種元素被組成單質的元素所替代。
置換反應必為氧化還原反應,但氧化還原反應不一定為置換反應。
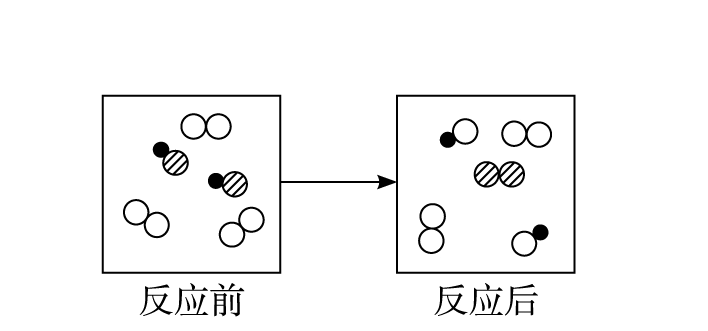
根據反應物和生成物中單質的類別,置換反應有以下4種情況:
1.較活潑的金屬置換出較不活潑的金屬或氫氣
2.較活潑的非金屬置換出較不活潑的非金屬
3.非金屬置換出金屬
4.金屬置換出非金屬
復分解反應:雙取代反應
簡記為:AB+CD=AD+CB :在水溶液中(又稱離子化的)兩個化合物交換元素或離子形成不同的化合物。即由兩種化合物互相交換成分,生成另外兩種化合物的反應。
復分解反應的本質是溶液中的離子結合成難電離的物質(如水)、難溶的物質或揮發性氣體,而使復分解反應趨于完成。酸、堿、鹽溶液間發生的反應一般是兩種化合物相互交換成分而形成的,即參加反應的化合物在水溶液中發生電離離解成自由移動的離子,離子間重新組合成新的化合物,因此酸、堿、鹽溶液間的反應一般是復分解反應。
復分解反應是離子或者離子團的重新組合,因為此類反應前后各元素的化合價都沒有變化,所以復分解反應都不是氧化還原反應。



